Tin tức chuyên ngành
NaOH là gì? Tính chất hóa học và ứng dụng trong cuộc sống
NaOH là gì? NaOH là một nguyên tố hóa học khá quen thuộc ở những năm còn ngồi trên ghế nhà trường. Thế nhưng, bạn đã biết NaOH thật ra ứng dụng rất nhiều trong cuộc sống của chúng ta. Cùng Havico xem ngay bài viết sau đây để nắm bắt thông tin chính xác nhất nhé!

NaOH là gì?
NaOH là công thức hóa học cho Hidroxit natri, một hợp chất hóa học quan trọng và được ứng dụng trong nhiều lĩnh vực khác nhau. Đây là một loại bazơ mạnh, cũng được gọi là bazơ kali, có khả năng tạo thành ion hidroxit (OH-) khi tan trong nước.

NaOH ở dạng rắn
Công thức hóa học NaOH biểu thị cho sự kết hợp của một nguyên tử Natri (Na), một nguyên tử oxi (O) và một nguyên tử Hiđro (H). Khi NaOH tan trong nước, nó phân li thành các ion natri (Na+) và ion Hidroxit (OH-). Đây là phương trình phản ứng hóa học nhằm tạo ra một dung dịch có tính bazơ mạnh.
NaOH được sản xuất thông qua quá trình điện phân dung dịch muối Natri. Nó có dạng bột màu trắng, hút ẩm từ không khí và dễ tan trong nước. Với tính bazơ mạnh, NaOH có khả năng tác động mạnh lên da và mô mềm, vì vậy cần phải cẩn thận khi sử dụng. Ngoài ra, NaOH cũng có khả năng gây ăn mòn và tác động tiêu cực đến môi trường nếu không được xử lý đúng cách.
Cấu tạo phân tử
Cấu tạo phân tử của NaOH bao gồm một nguyên tử natri (Na), một nguyên tử oxi (O) và một nguyên tử hiđrô (H). Khi NaOH tan trong nước, phân tử NaOH phân li thành ion natri (Na+) và ion hidroxit (OH-).
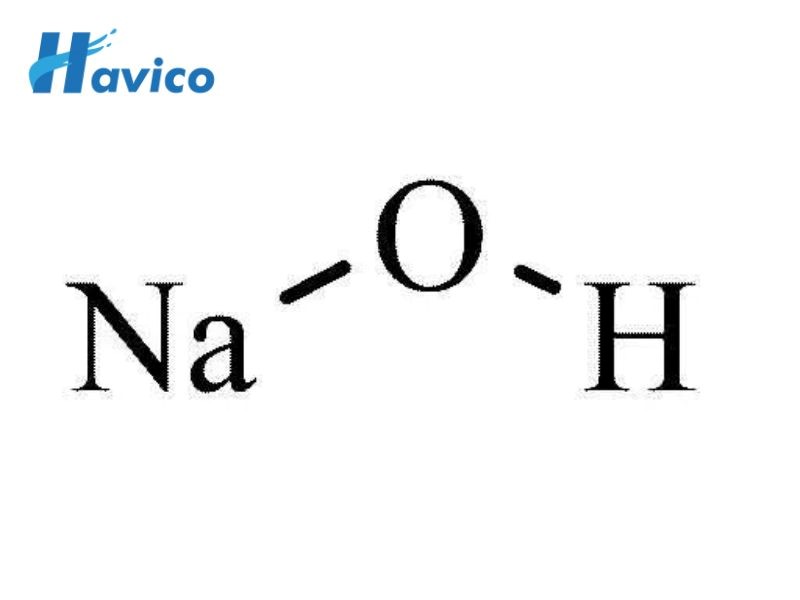
Cấu trúc phân tử NaOH
Cấu trúc phân tử NaOH có thể được miêu tả như sau:
- Nguyên tử natri (Na) nằm ở trung tâm và kết nối với nguyên tử oxi (O) thông qua liên kết ion (Na+ – O-).
- Nguyên tử oxi (O) nằm bên cạnh nguyên tử hiđrô (H) và kết nối với nó thông qua liên kết cộng hóa trị (O-H).
Do đó, cấu trúc phân tử NaOH có dạng OH-, với nguyên tử oxi nắm giữ ion hidroxit (OH-) và nguyên tử natri tạo thành ion natri (Na+).
NaOH (Natri hiđroxit) – Tính chất vật lý của NaOH là gì?
- NaOH (Natri Hiđroxit) là một chất rắn tinh thể có màu trắng. Trong điều kiện thông thường, NaOH hút ẩm từ không khí, tạo thành một dung dịch dễ tan trong nước.
- Điểm nóng chảy: NaOH có điểm nóng chảy khá cao, khoảng 318 độ C tương đương với 605 độ F. Khi nhiệt độ cao hơn điểm nóng chảy, natri hidroxit sẽ chuyển từ dạng rắn sang dạng lỏng.
- Dung lượng hơi: NaOH có dung lượng hơi thấp, chính vì vậy nó khó bay hơi ở nhiệt độ phòng.
- Độ hòa tan trong nước: NaOH là một bazơ mạnh và dễ tan trong nước. Quá trình tan NaOH trong nước tạo thành một dung dịch có tính bazơ mạnh, có khả năng tạo thành ion hidroxit (OH-) và ion natri (Na+).
- Tính ăn mòn: NaOH là một chất ăn mòn mạnh và có khả năng tác động tiêu cực lên da, mô mềm và các vật liệu khác. Cần phải chú ý và sử dụng biện pháp bảo vệ cá nhân khi làm việc với NaOH.
- Tính điện dẫn: Dung dịch NaOH là một điện giải mạnh, có khả năng dẫn điện tốt do sự tồn tại của ion natri (Na+) và ion hidroxit (OH-).
NaOH ( Natri hiđroxit) – Tính chất hóa học
NaOH (Natri hiđroxit) là một chất hóa học quan trọng với nhiều tính chất hóa học đáng chú ý. Dưới đây là một số tính chất hóa học của NaOH:
- Bazơ mạnh: NaOH là một bazơ mạnh trong dung dịch nước. Khi tan trong nước, nó phân li thành ion hidroxit (OH-) và ion natri (Na+). Tính chất bazơ mạnh của NaOH cho phép nó tác động với các chất axit, tạo thành muối và nước trong các phản ứng trung hòa.
Ví dụ: NaOH + HCl → NaCl + H2O
- Phản ứng oxi hóa: NaOH có khả năng tham gia các phản ứng oxi hóa. Nó có thể oxi hóa các chất khác và chuyển đổi thành các sản phẩm mới.
Ví dụ: 2NaOH + Cl2 → NaCl + NaClO + H2O
- Tác dụng với kim loại: NaOH có khả năng tác dụng với nhiều kim loại khác nhau. Khi tác dụng với nhôm (Al) hoặc kẽm (Zn), NaOH tạo thành khí hiđro (H2) và muối kim loại.
Ví dụ: 2NaOH + 2Al → 2NaAlO2 + H2
- Phản ứng trung hòa axit: NaOH có khả năng trung hòa các axit. Với tính chất bazơ mạnh, NaOH tác động vào axit để tạo thành muối và nước trong quá trình trung hòa.
Ví dụ: NaOH + H2SO4 → Na2SO4 + H2O
- Sử dụng trong xà phòng hóa: NaOH được sử dụng rộng rãi trong quá trình xà phòng hóa, trong đó nó tác động lên dầu và chất béo để tạo thành xà phòng và glycerin.
Ví dụ: NaOH + CH3(CH2)16COOH (axit stearic) → CH3(CH2)16COONa (muối natri stearat) + H2O
- Tác dụng với chất hữu cơ: NaOH cũng có khả năng tác động với các chất hữu cơ, ví dụ như các axit carboxylic, để tạo ra muối và nước.
Ví dụ: NaOH + CH3COOH (axetơ axetic) → CH3COONa (muối natri axetat) + H2O
Tính chất hóa học NaOH
Phương pháp điều chế NaOH là gì?
Điều chế Natri Hiđroxit được chia thành hai dạng chính là điều chế trong phòng thí nghiệm và điều chế trong công nghiệp. Cùng Havico xem qua ngay những cách điều chế đó là gì nhé!

Điều chế Natri Hidroxit
Trong phòng thí nghiệm
Để điều chế Natri Hiđroxit trong phòng thí nghiệm, ta có thể thực hiện theo các bước sau đây:
- Bước 1: Chuẩn bị dung dịch axit clohidric (HCl) hoặc axit sulfuric (H2SO4).
- Bước 2: Chuẩn bị muối Natri Sulfat (NaSO4) hoặc Natri Clorua (NaCl).
- Bước 3: Thêm từ từ dung dịch muối vào bình chứa dung dịch axit, khuấy đều để phản ứng trung hòa xảy ra, tạo thành muối Natri và nước.
- Bước 4: Sau khi phản ứng trung hòa hoàn toàn, dung dịch sẽ tách thành hai lớp, một là lớp nước và một là lớp muối natri. Lấy lớp muối natri đem cô đặc.
- Bước 5: Đun sôi dung dịch muối natri trên bếp hâm nóng hoặc bằng cách sử dụng máy chưng cất. Khi nước trong dung dịch bay hơi, muối natri sẽ cô đặc lại.
- Bước 6: Để nguội, NaOH tinh khiết sẽ kết tinh thành dạng tinh thể. Ta thu được hợp chất NaOH.
Trong công nghiệp
Trong công nghiệp, Natri hiđroxit (NaOH) được điều chế theo phương pháp điện phân dung dịch muối natri (NaCl).
Sử dụng một hệ thống điện phân, như một bể điện phân. Điện phân có thể được thực hiện bằng cách sử dụng hai cực điện (cực âm và cực dương) và áp dụng điện áp qua chúng.
Cực âm làm từ thép không gỉ, còn cực dương làm từ nguyên tố titanium. Khi điện áp được áp dụng qua cực âm và cực dương, quá trình điện phân xảy ra. Các ion natri (Na+) di chuyển đến cực âm, trong khi các ion clo (Cl-) di chuyển đến cực dương. Ở cực âm, các ion natri nhận được electron và chuyển thành nguyên tử natri, còn ở cực dương, các ion clo mất electron và chuyển thành phân tử clo (Cl2).
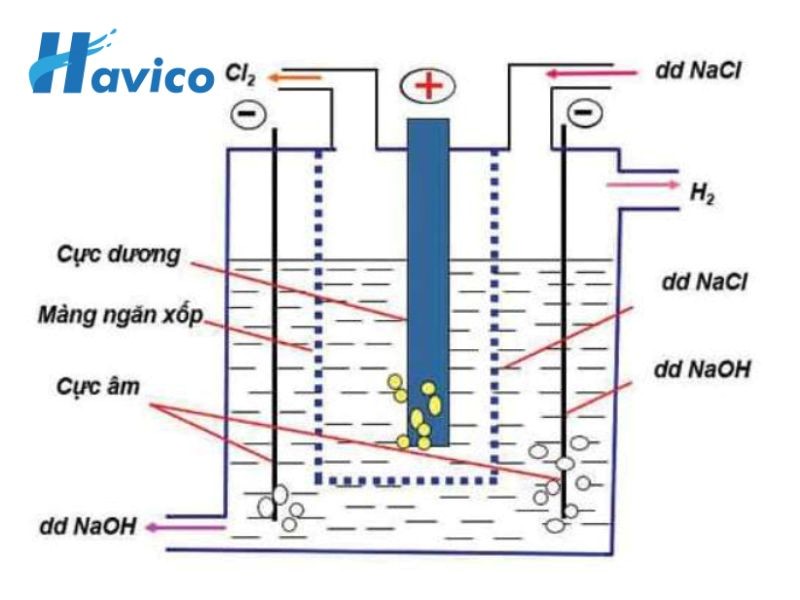
Điều chế NaOH bằng cách điện phân
Trên cực dương, các phân tử clo (Cl2) kết hợp với nước tạo thành axit clohidric (HCl), trong khi tạo ra khí oxy (O2). Axit clohidric sau đó có thể được sử dụng lại trong quá trình sản xuất khác. Trong quá trình này, ion hidroxit (OH-) được tạo ra từ cực âm, trong khi ion natri (Na+) di chuyển vào dung dịch.
Ở cực âm, các nguyên tử natri kết hợp với các ion hidroxit (OH-) trong dung dịch tạo thành natri hiđroxit (NaOH). Trong quá trình này, NaOH tạo thành một dung dịch nồng độ cao. Trong khi đó, tại cực dương, phân tử clo (Cl2) tạo thành axit clohidric (HCl) khi kết hợp với nước.
Lưu ý khi điều chế NaOH
Khi điều chế NaOH, cần phải lưu ý một số điều sau đây để quá trình điều chế diễn ra hiệu quả mà vẫn đảm bảo được an toàn.
- An toàn cá nhân: Khi làm việc với NaOH, cần đảm bảo sự an toàn cá nhân. Điều này bao gồm đeo bảo hộ cá nhân như mũ bảo hộ, mắt kính, găng tay hóa chất và áo choàng bảo hộ. Nên làm việc trong một môi trường thông gió tốt và tránh tiếp xúc trực tiếp với da và mắt.
- Điều kiện làm việc: Thực hiện quá trình điện phân trong một không gian được thông gió tốt để ngăn ngừa tích tụ các khí độc hại như axit clohydric (HCl) và khí clo (Cl2). Đảm bảo có đủ ánh sáng và không có nguồn lửa mở trong khu vực làm việc.
- Quản lý sản phẩm: Sau khi quá trình điện phân hoàn thành, cần xử lý và lưu trữ sản phẩm NaOH một cách an toàn. NaOH có tính ăn mòn cao, do đó, cần đảm bảo rằng nó không tiếp xúc với da, môi trường hay các chất khác gây phản ứng nguy hiểm.
- Xử lý chất thải: Chất thải từ quá trình điều chế NaOH cần được xử lý một cách an toàn và tuân theo quy định về môi trường và an toàn. Chất thải NaOH có tính ăn mòn và phải được xử lý theo các quy trình phù hợp để đảm bảo không gây hại cho môi trường và sức khỏe con người.
NaOH có độc không?
Natri hiđroxit (NaOH) là một chất ăn mòn mạnh và có tính ăn da. Điều này có nghĩa là NaOH có thể gây kích ứng và sẽ gây tổn thương cho da, mắt, đường hô hấp và niêm mạc.

NaOH có độc không?
Khi tiếp xúc trực tiếp với da, Hidroxit natri có thể gây chảy máu, phồng rộp, viêm nhiễm và gây bỏng da nghiêm trọng. Nếu NaOH tiếp xúc với mắt, nó có thể gây chảy nước mắt, viêm nhiễm và gây tổn thương nghiêm trọng cho mắt.
Ngoài ra, hơi của NaOH cũng có thể gây kích ứng đường hô hấp và niêm mạc trong trường hợp hít phải nồng độ cao.
Do tính ăn mòn và độc tính của nó, khi làm việc với Hidroxit natri yêu cầu tuân thủ các biện pháp an toàn đầy đủ, bao gồm sử dụng thiết bị bảo hộ cá nhân, như găng tay, mắt kính, để đảm bảo sự an toàn cho người làm việc.
Ứng dụng NaOH (Natri hiđroxit) trong cuộc sống
NaOH là một hóa chất công nghiệp có nhiều ứng dụng giá trị trong đời sống thường ngày của chúng ta. Hầu hết các ngành công nghiệp đều sẽ có sử dụng loại hóa chất này. Ngay sau đây, hãy cùng Havico xem qua một vài ứng dụng phổ biến của loại hóa chất này nhé!
Ứng dụng của xút NaOH
#1 NaOH có vai trò xử lý nước trong bể bơi
NaOH có vai trò xử lý nước trong bể bơi để đảm bảo nước luôn trong tình trạng sạch sẽ và an toàn cho người sử dụng. Hidroxit natri sẽ thường được sử dụng để gia tăng nồng độ pH cho bể bơi.
Hồ bơi cần phải có độ pH được duy trì trong khoảng từ 7,2 đến 7,8 nhằm đảm bảo các chất khử trùng Clo sẽ hoạt động hiệu quả. Nếu độ pH quá cao hay quá thấp đều sẽ gây ảnh hưởng đến hiệu quả mà các chất khử trùng mang lại, từ đó tạo điều kiện thuận lợi cho sự phát triển của vi khuẩn và tảo trong nước.
NaOH sẽ hoạt động như một chất bazơ mạnh, có khả năng tương tác với axit và làm tăng độ pH của nước.
#2 Ứng dụng của NaOH là gì trong công nghiệp dệt và nhuộm màu?
NaOH cũng đóng một vai trò quan trọng trong ngành công nghiệp dệt và nhuộm màu. Trong quá tình sản xuất sợi, hóa chất này được sử dụng để tẩy trắng và làm sạch sợi tự nhiên, chẳng hạn như sợi bông và sợi lanh. NaOH giúp loại bỏ các chất cặn bẩn, chất tẩy và chất màu từ sợi, làm cho chúng trở nên sáng và sạch hơn.

Công nghiệp nhuộm, may mặc
Trong quá trình xử lý vải, NaOH được sử dụng để làm mềm vải, tẩy trắng và làm sạch các chất ô nhiễm trên bề mặt vải. Ngoài ra, Hidroxit natri cũng có thể được sử dụng trong quá trình mài mòn vải để tạo hiệu ứng xước hoặc nhạt trên bề mặt vải, tạo nên các kiểu dáng và hoa văn đặc biệt.
Ngoài ra, NaOH được sử dụng để tạo chất nền nhuộm. Chất nền nhuộm có thể cung cấp môi trường pH phù hợp và các điều kiện hoá học tối ưu để màu nhuộm thẩm thấu sâu và ổn định trên sợi vải.
#3 Công nghiệp dầu khí
NaOH cũng được sử dụng để tách các chất ô nhiễm hữu cơ khác nhau khỏi dầu và khí. Nó có khả năng tẩy rửa và làm sạch các chất cặn, axit, chất bẩn và chất độc khác trong quá trình sản xuất và xử lý dầu và khí.
Trong quá trình sản xuất xà phòng và chất tẩy rửa, NaOH được sử dụng như một nguyên liệu để tách glycerin từ dầu và bơ. Nó cũng được sử dụng để điều chỉnh pH và cân bằng hóa chất trong các công thức sản xuất xà phòng và chất tẩy rửa.
#4 Chế biến thực phẩm
Trong quá trình sản xuất dầu động vật, như dầu cá, dầu đậu nành, hoặc dầu cây cỏ, các thành phần như axit béo tự nhiên có thể tồn tại. Tuy nhiên, axit béo này thường không thích hợp cho mục đích sử dụng cuối cùng. Do đó, quá trình tinh chế dầu động vật sẽ sử dụng NaOH thực hiện để loại bỏ axit béo và các chất tương tự.
Hidroxit natri cũng được sử dụng để sản xuất các chất bảo quản thực phẩm, chẳng hạn như sodium benzoate và sodium propionate. Các chất bảo quản này được sử dụng để kéo dài tuổi thọ và bảo quản thực phẩm, ngăn chặn sự phát triển của vi khuẩn và nấm mốc.
#5 Công nghiệp sản xuất gỗ, giấy
Trong ngành công nghiệp sản xuất gỗ, NaOH được sử dụng để tẩy trắng và làm sạch gỗ. Nó có khả năng loại bỏ các chất ô nhiễm như bụi, dầu mỡ và các chất hữu cơ khác bám trên bề mặt gỗ, làm cho gỗ trở nên sạch, trơn nhẵn và sẵn sàng cho các quá trình tiếp theo như mài, sơn…
Đối với quá trình sản xuất giấy, NaOH được sử dụng để tách các sợi gỗ từ nhau và loại bỏ các chất cặn, lignin và chất ô nhiễm khác. Đây là quá trình tách chất lignocellulose để thu được sợi cellulose trong quá trình chế biến giấy.

Ngành công nghiệp sản xuất giấy
#6 Công nghiệp năng lượng
NaOH được sử dụng để xử lý nước nguồn trong các nhà máy nhiệt điện hoặc nhà máy sản xuất năng lượng từ các nguồn nhiên liệu như than, dầu mỏ, khí đốt. Hóa chất giúp điều chỉnh độ pH của nước, loại bỏ các chất hữu cơ và hợp chất không mong muốn khác, từ đó giúp tăng hiệu suất và tuổi thọ của các thiết bị.
Trong các nhà máy điện hoặc các công trình công nghiệp khác, NaOH được sử dụng để xử lý khí thải từ quá trình đốt cháy nhiên liệu. Khí thải thường chứa các chất gây ô nhiễm như SO2 (sunfua dioxide), NOx (nitrogen oxides) và CO2 (carbon dioxide). NaOH được sử dụng để hấp phụ các chất này và giảm thiểu tác động tiêu cực lên môi trường.

Công nghiệp năng lượng
Quá trình sản xuất pin điện hóa, NaOH được sử dụng để tạo ra dung dịch điện phân, cần thiết cho các phản ứng hóa học trong quá trình sản xuất pin. Dung dịch NaOH giúp cung cấp ion hydroxide (OH-) và điều chỉnh độ pH để đạt được hiệu suất tối ưu trong quá trình điện phân.
#7 Khử trùng thiết bị y tế
NaOH có tính kiềm mạnh và khả năng khử trùng cao, do đó nó được sử dụng để khử trùng và làm sạch các công cụ y tế như dao mổ, kìm, ống nghiệm và nhiều loại thiết bị y tế khác. Hidroxit natri có khả năng tiêu diệt các vi khuẩn, vi rút và các tác nhân gây bệnh khác.
#8 Natri hidroxit trong sản xuất chất tẩy giặt
NaOH là một chất kiềm mạnh, có khả năng tăng độ pH của dung dịch. Trong quá trình sản xuất chất tẩy giặt, được sử dụng để kiềm hóa các chất hoạt động bề mặt (surfaktan) như dodecyl benzen sulfonate (DBS), ethoxylate, hay alkyl sulfate. Việc kiềm hóa này giúp tăng khả năng làm sạch của các chất tẩy giặt.

Chất tẩy rửa giặt tẩy NaOH
Ứng dụng của NaOH trong dược phẩm và hóa chất
Trong dược phẩm: NaOH có thể được sử dụng để điều chỉnh độ pH trong quá trình sản xuất các dạng dược phẩm khác nhau như viên nén, hỗn dịch, kem, hoặc dung dịch tiêm.

Sản xuất thuốc
Trong hóa chất: NaOH có thể được sử dụng trong các quá trình xử lý nước và xử lý nước thải. Natri hidroxit giúp điều chỉnh độ pH, tẩy rửa các chất hữu cơ và loại bỏ các chất ô nhiễm khác từ nước hoặc nước thải.
Lưu ý khi sử dụng và bảo quản NaOH (xút)
- Điều chỉnh độ pH cẩn thận: NaOH là chất kiềm mạnh và có khả năng gây ăn mòn. Khi điều chỉnh độ pH của dung dịch, hãy thêm NaOH từ từ và kỹ lưỡng để tránh tạo ra một phản ứng quá nhiệt hoặc bắn tia.
- Lưu trữ trong điều kiện an toàn: NaOH cần được lưu trữ trong điều kiện an toàn và khô ráo. Đảm bảo đậy kín bao bì của hóa chất để tránh tiếp xúc với không khí và độ ẩm.
- Tránh tiếp xúc với chất hữu cơ: NaOH không nên tiếp xúc với chất hữu cơ, nhưngan, dầu hoặc các chất dễ cháy khác. Khi tiếp xúc với các chất này, có thể xảy ra phản ứng mạnh và nguy hiểm.
- Tránh tiếp xúc với nước: Khi làm việc với NaOH, tránh tiếp xúc với nước. Khi NaOH tiếp xúc với nước, phản ứng exothermic xảy ra, giải phóng nhiệt và có thể gây cháy hoặc bắn tia.
- Vận chuyển an toàn: Khi vận chuyển NaOH, đảm bảo đậy kín và đóng gói chặt chẽ để tránh rò rỉ hoặc tiếp xúc với các chất khác. Tuân thủ các quy định vận chuyển hóa chất cục bộ và quốc gia.
Trên đây là một số thông tin quan trọng về hóa chất NaOH là gì? mà Havico mong muốn gửi đến bạn. Nếu bạn cảm thấy những thông tin trên là hữu ích hãy chia sẻ nó đến với nhiều người hơn và thường xuyên theo dõi website của chúng tôi để nhận ngay các thông tin mới nhất nhé!


